Агрегатные состояния вещества
с точки зрения электромагнитной термодинамики
Важнейшими процессами в окружающем нас мире являются трансформации агрегатного состояния вещества — переход между твёрдым и жидким состояниями (плавление и кристаллизация), а также между жидким и газообразным (испарение и конденсация). Поэтому объяснение различных свойств агрегатных состояний вещества и анализ экспериментальных данных по этим процессам с точки зрения электромагнитной термодинамики (ЭМТ) особенно интересен.
Общие замечания
Взаимодействие атомов и молекул. Кривая взаимодействия
О термине «молекула»
Твёрдое агрегатное состояние вещества
Твёрдое состояние вещества на кривой взаимодействия
Фазовые переходы второго рода
Тепловое движение молекул твёрдых веществ
Изменение свойств твёрдых веществ с температурой
Механизмы повышения пластичности при нагреве
Плавление и кристаллизация
Суть процесса плавления
Энергия плавления
Температура плавления
О различии температур плавления
Стабильность температуры плавления
Кристаллизация
Центры кристаллизации
Стабильность температуры кристаллизации
Вещество в окрестностях точки плавления
Аномалии при плавлении и кристаллизации
Жидкое агрегатное состояние вещества
Объяснение основных свойств жидкости
Механизм обеспечения жидкого состояния
Жидкое состояние вещества на кривой взаимодействия
Псевдокристаллы и жидкостное трение
Псевдокристаллы и струйки
Вязкость, жидкостное трение и сверхтекучесть
Поддержание равновесия между жидкостью и паром
Поддержание жидкого состояния в двухкомпонентной системе
Поддержание жидкого состояния в трёхкомпонентной системе
Динамический баланс у поверхности жидкости
Как предотвратить испарение
Смачиваемость и растворяемость
Смачиваемость
Растворение и некоторые другие химические реакции
Абсорбция и диффузия газов
Когда смачиваемое не смачивается?
Поверхностное натяжение
Испарение и конденсация
Суть процессов испарения и конденсации
Механизмы испарения и конденсации
Физический смысл понятия критической точки системы «жидкость-пар»
Энергия испарения и конденсации
Причины появления теплоты испарения-конденсации
Оценка теплоты испарения-конденсации
Газообразное состояние вещества
Газообразное состояния вещества на кривой взаимодействия
Особенности газообразного состояния вещества
Особенности разреженных газов
Особенности газов под высоким давлением
Особенности газов при нагревании
Агрегатные состояния вещества на кривой взаимодействия
Общие замечания
Взаимодействие атомов и молекул. Кривая взаимодействия
Постулаты электромагнитной термодинамики (ЭМТ) утверждают электродинамический характер взаимодействия атомов, в результате которого атомы, являющиеся ассоциациями взаимно скомпенсированных, но разнесённых в пространстве электрических зарядов, могут испытывать как притяжение, так и отталкивание, — в зависимости от расстояния между атомами и их взаимной ориентации.
Это положение является важнейшим при рассмотрении особенностей и свойств различных агрегатных состояний вещества, и прежде всего наиболее сложного для понимания всех его особенностей «промежуточного» агрегатного состояния — жидкости. Подробно рассмотрение особенностей электростатического варианта такого взаимодействия и обоснование адекватности распространения этих тенденций на электродинамическое взаимодействие изложено на отдельной странице, рисунок с которой представлен ниже.
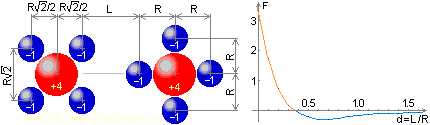 Скомпенсированные конфигурации зарядов, испытывающие притяжение или отталкивание в зависимости от расстояния между ними. Справа показан график изменения силы взаимодействия F в зависимости от относительного расстояния d = L / R. Красный участок графика соответствует взаимному притяжению, а синий — отталкиванию.
Для обсуждаемой темы определяющее значение имеет представленный на нём график. Назовём его «кривой взаимодействия». Особо отмечу, что эта кривая не нарисована по наитию, а создана в результате строгого расчёта. Однако здесь учтены лишь электрические компоненты взаимодействия, дающие бесконечно большую силу при тесном сближении зарядов. Между тем о бесконечно тесном сближении в реальном мире речь не идёт — на расстояниях порядка 2·10–15 м начинают действовать силы отталкивания, формирующие нейтронный барьер. Но нейтронный барьер, не дающий слиться протонам с электронами из электронных слоёв атома, в межатомных взаимодействиях актуален главным образом для ядер водорода, не имеющих заполненных внутренних электронных оболочек. У всех остальных атомов такие оболочки есть, и за счёт взаимного отталкивания они не дают атомам слиться друг с другом, удерживая их на дистанциях, примерно равных размерам атома, а отнюдь не размерам элементарных частиц. С учётом этого факта кривая взаимодействия должна выглядеть примерно так, как показано ниже.
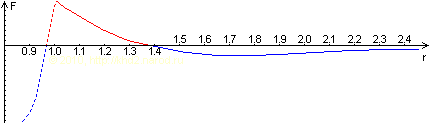 Примерный вид кривой взаимодействия с учётом отталкивания внутренних электронных оболочек. В отличии от предыдущей картинки, расстояние r здесь — это расстояние между центрами взаимодействующих атомов, выраженное в их диаметрах в свободном состоянии (примерно 10–10 м). Нерасчётная (предполагаемая) часть показана пунктиром.
Рассматривая кривую взаимодействия, следует обратить внимание на одно обстоятельство — и дистанция, где притяжение сменяется отталкиванием, и дистанция, на которой отталкивание при дальнейшем расхождении атомов достигает максимальной величины, лежат очень близко — в пределах заметно меньших, чем диаметр одного атома.
Представленная кривая является ориентировочной и зависит как от самих атомов, так и от их взаимного положения, в частности, возможно отсутствие «положительного» участка взаимного притяжения и даже монотонное нарастание силы отталкивания по мере сближения. Но при отсутствии других факторов наиболее энергетически выгодной взаимной ориентацией будет та, которая обеспечивает минимальное взаимное отталкивание и максимальное притяжение, то есть именно то, что показано на рисунке. Для разных атомов кривые взаимодействия могут различаться как по дистанциям, соответствующим точкам перегиба, так и по величине силы в этих точках. Однако эти отличия почти всегда будут измеряться процентами или десятками процентов, но не порядками величин. Например, на основании коэффициентов температурного расширения твёрдых веществ и удельных плотностей жидкостей при разных температурах я заключаю, что в отличии от данной кривой, рассчитанной для условных «атомов» с точечными «электронами», у реальных атомов с электронами, «размазанными» по орбиталям, область сил притяжения более сжата, а вот дистанция между переходом силы в отрицательную область и максимальным отталкиванием более растянута, скажем для воды эти величины я оцениваю в 5% и 45% от размера свободной молекулы соответственно. Именно поэтому я уделил столько внимания этой кривой.
В дальнейшем на этой странице я не раз буду использовать график кривой взаимодействия и видоизменять его, и эти рисунки уже не будут результатами расчёта. Чтобы не путать их с графиком, построенным по расчётным значениям, на них будет отсутствовать числовая разметка осей.
Показанный вид кривой взаимодействия соответствует простейшему случаю — взаимодействию двух четырёхэлектронных атомов. Очевидно, что для других конфигураций зарядов её вид изменится, в частности, нельзя исключать возможность появления нескольких экстремумов притяжения и отталкивания, что существенным образом может не только влиять на процессы плавления-кристаллизации и испарения-конденсации, но и обуславливать фазовые переходы второго рода внутри одного агрегатного состояния вещества.
О термине «молекула»
Ещё одно замечание о термине «молекула», используемом на этой странице. При расчётах он используется в химическом смысле, но при рассуждениях о протекании процессов на качественном уровне обычно применяется в физическом смысле — молекулы рассматривается как ассоциации атомов, силы связи внутри которых значительно крепче, чем между ними и соседними атомами или ассоциациями атомов.
Твёрдое агрегатное состояние вещества
Общепризнано, что твёрдые тела образованы атомами, прочно зафиксированными на своих местах в кристаллической решётке. А столь прочно удерживает их именно межатомное электрофизическое взаимодействие, а точнее — взаимное притяжение. Теперь мы знаем, что это действительно так, причём конфигурация кристаллической решётки определяется конфигурациями внешних электронных оболочек атомов — валентной и предшествующей ей. Тем не менее, температура оказывает важное влияние на свойства твёрдых веществ.
Твёрдое состояние вещества на кривой взаимодействия
Прежде всего посмотрим, как твёрдое состояние вещества соотносится с кривой взаимодействия.
 Особенности твёрдого состояния вещества на кривой взаимодействия (межмолекулярное расстояние d зависит от температуры вследствие теплового расширения).
На этой кривой твёрдому состоянию соответствует вся область положительных сил, то есть вся область взаимного притяжения. При этом фазовые переходы второго рода отображаются на графике в виде скачков. Возможно, корректнее было бы изобразить их как разрывы графика. К тому же скачки этих переходов необязательно строго вертикальны — в координатах графика они могут иметь как положительный, так и отрицательный наклон, в зависимости от того, сопровождается ли перестройка увеличением или уменьшением межмолекулярных расстояний.
Фазовые переходы второго рода
Хорошо известно, что изменение температуры твёрдого вещества может сопровождаться периодическими массовыми изменениями его кристаллической структуры — фазовыми переходами второго рода, отражающими изменение внутриатомных конфигураций по мере изменения внутреннего возбуждения атомов.
Теоретически в результате внутренней переконфигурации атомов по мере роста возбуждения их взаимное притяжение может как уменьшиться, так и возрасти. Однако последнее представляется намного менее вероятным, по крайней мере смоделировать такую ситуацию мне не удалось. А вот особенности внутренней конфигурации самих атомов, как показало моделирование, вполне могут привести к гистерезису этих конфигураций, и тогда одновременно могут существовать несколько фаз твёрдого тела. Описанный выше механизм позволяет существовать нескольким фазам в определённом диапазоне температур при любой, сколь угодно медленной скорости охлаждения или нагрева. Хотя надо заметить, что на практике наиболее частый способ получить несколько фаз одновременно — это очень быстрый отбор энергии (закалка), когда кристаллическая решётка просто «не успевает» перестроиться полностью, и части вещества «застревают» в энергетически не оптимальной для данной температуры конфигурации, фиксируясь за счёт прочности успевшего перестроится окружения. Возникающие при этом внутренние напряжения обеспечивают повышенную твёрдость в сочетании с повышенной хрупкостью.
Тепловое движение молекул твёрдых веществ
Взаимное притяжение молекул образует крепкие связи, надёжно удерживающие их на своих местах. Механические импульсы, которые они получают при квантовом обмене, мизерны по сравнению с этими силами и быстро рассеиваются по всему объёму кристалла. Поэтому можно с уверенностью сказать, что молекулы твёрдого тела не имеют существенного теплового движения и весьма прочно зафиксированы на своих местах. Все механические импульсы преобразуются в волны механических напряжений и частично — во внутреннее возбуждение атомов, прежде всего в точках пучностей при интерференции этих волн. Но поскольку обычно волны напряжений носят вполне хаотический характер, то эти пучности постоянно меняют своё местоположение, возникая то в одном, то в другом месте твёрдого вещества.
Тепловое расширение твёрдых веществ
Однако «не имеют существенного движения» не значит «не имеют никакого»! Изменения напряжения межатомных связей при прохождении механических волн неизбежно приводят к смещениям атомов, вызывая своего рода «дрожь», и чем интенсивнее эти волны (т.е. перепады напряжений), тем интенсивнее и смещение атомов, обуславливающее их некоторое «расталкивание», которое увеличивает среднее межатомное расстояние с ростом температуры. По мере роста температуры растёт и внутреннее тепловое возбуждение атомов, что также может способствовать увеличению их «внешнего размера». Впрочем, влияние обоих факторов остаётся малым, что хорошо видно из значений коэффициента теплового расширения — для большинства твёрдых веществ он составляет тысячные доли процента при изменении температуры на 1 К. Таким образом, во всём диапазоне температур существования твёрдой формы того или иного вещества от абсолютного нуля до температуры плавления его размеры изменяются обычно на единицы процентов у простых веществ, и максимум на десяток-другой процентов у пластмасс и других органических веществ с большими молекулами.
Изменение свойств твёрдых веществ с температурой
При крайне низких температурах вещества обычно бывают очень твёрдыми, но весьма хрупкими. С повышением температуры твёрдость снижается, а пластичность растёт. В результате общая прочность, определяемая комбинацией твёрдости и пластичности, имеет наибольшее значение при некоторой оптимальной температуре. При слишком низких температурах материал под воздействием нагрузок легко раскалывается из-за излишней хрупкости, а при слишком высоких — легко рвётся из-за излишней пластичности. В чём же дело?

|
Если мы посмотрим на кривую взаимодействия, то увидим, что в области твёрдого состояния вещества сила взаимодействия образует характерный «горб». По мере нарастания температуры и связанного с этим роста межатомного расстояния, точка, соответствующая текущему состоянию вещества, смещается слева направо. При этом сила притяжения сначала нарастает, достигая своего максимального значения. Этот участок соответствует резкому снижению хрупкости при небольшом увеличении пластичности. Вершина горба соответствует максимальной прочности. Затем по мере роста межатомного расстояния сила взаимного притягивания начинает снижаться, а это ведёт к дальнейшему снижению хрупкости при сильном повышении пластичности.
Теперь посмотрим на это явление не со стороны достаточно абстрактной кривой взаимодействия, а со стороны вполне конкретных межатомных связей.
Когда температура низка, атомы возбуждены слабо, мало подвижны и упакованы плотно, делая вещество очень твёрдым. Как известно из материаловедения, любой реальный кристалл имеет дефекты кристаллической решётки в глубине и особенно на поверхности, а также весьма часто — посторонние включения. В таких местах естественным образом концентрируются напряжения. При резком превышении определённого порога (скажем, при достаточно сильном ударе) в таких местах межатомная связь разрывается, атомы раздвигаются, а как мы знаем, небольшое увеличение расстояния между атомами способно резко ослабить силу притяжения и даже превратить её в силу отталкивания. При этом остальные атомы остаются упакованными по-прежнему плотно и не могут подвинуться, перераспределяя нагрузку, которая остаётся сконцентрированной в месте начала трещины. Зато по направлению трещины на связь между следующими атомами ложится двойная нагрузка — к собственной добавляется ещё и та, которую удерживала разорванная связь. Поэтому следующая связь также рвётся. Точка максимальной концентрации напряжений переходит к следующей связи, а приходящаяся на неё нагрузка возрастает ещё больше — рвётся и эта связь. Происходит цепная реакция разрушения связей в направлении роста трещины, пробегающая до противоположной границы вещества — кусок раскалывается. Характерно, что при достаточно плавном увеличении воздействия многие хрупкие материалы, такие, как стекло, способны выдержать весьма большие нагрузки, а вот даже относительно слабые, но резкие удары легко разрушают их. Из-за жёсткой фиксации атомы не успевают подстроиться к быстро изменяющимся условиям и избежать разрыва связей.
С ростом температуры межатомные расстояния увеличиваются по всему объему вещества, давая несколько бóльшую свободу для переконфигурации атомов, а вместе с этим возрастают и межатомные силы притяжения, приближаясь к своему максимуму. Из-за увеличения межатомных расстояний пластичность материала несколько возрастает, и атомы успевают компенсировать даже достаточно быстрые изменения нагрузок, перемещаясь в оптимальные положения без фатального разрушения связей с соседями, что наряду с заметным повышением межатомных сил взаимодействия увеличивает общую прочность вещества.
Тут возникает вопрос — почему же этого не происходит при более низких температурах, ведь в момент образования трещины атомы на её краях тоже расходятся, и сила их притяжения сначала возрастает? Да, но тогда эта сила возрастает лишь в точке разрыва, и этого недостаточно для противодействия росту трещины. С ростом же температуры вещества сила взаимного притяжения атомов увеличивается по всему его объёму, и тогда вещество уже способно успешно противостоять возникновению и росту трещин при тех напряжениях, которые вызывали его раскол на бóльшем холоде.
Наконец, дальнейший рост температуры приводит к тому, что атомы расходятся всё дальше и межатомные силы начинают ослабевать, причём по мере разогрева всё более и более заметно. Естественно, что это приводит к нарастающему снижению твёрдости и возрастанию пластичности. Уменьшение межатомного притяжения снижает общую прочность.
О том, на каком расстоянии перестают действовать силы притяжения, можно судить по относительному удлинению того или иного вещества при разрыве из-за растяжения. Для большинства кристаллических веществ это удлинение составляет всего несколько процентов (как правило, оно несколько больше термического расширения из-за переконфигурации атомов — утоньшения при удлинении, — но эти параметры вполне сравнимы). Однако это удлинение меньше, чем изменение объёма при плавлении того же вещества, потому что при изменении объёма в момент плавления свою роль играет сам механизм этого процесса.
Плавление и кристаллизация
По мере дальнейшего повышения температуры сила межатомной связи уменьшается настолько, что атом уже не в состоянии удерживать связь со всеми своими соседями, необходимыми для существования стационарной кристаллической решётки.
Суть процесса плавления
При приближении температуры твёрдого вещества к температуре плавления, его молекулы, поглощая кванты или приобретая дополнительную энергию механическим путём, всё более возбуждаются, поэтому плотность энергии, находящейся в твёрдом веществе прежде всего в виде волн внутренних напряжений, всё более возрастает. В связи с этим межатомные расстояния увеличиваются. В пучностях волн напряжений, периодически возникающих то в одном, то в другом месте, возбуждение достигает максимума, и расстояние между отдельными атомами превышает расстояние Ван-дер-Ваальса rvvv, соответствующее смене силы притяжения на силу отталкивания. Что произойдёт в этом случае?

|
На рисунке в виде условных шариков показаны три атома в ситуации, когда правый атом (более светлый) удалился от среднего на расстояние, большее расстояния Ван-дер-Ваальса. В результате средний атом, ранее испытывавший слабое притяжение и слева, и справа, теперь испытывает притяжение только слева (красные стрелки), а справа — отталкивание (синие стрелки). Естественно, под влиянием такой пары сил он сместится ещё левее, в сторону притяжения, а в соответствии с кривой взаимодействия это вызовет дополнительное нарастание как силы притяжения, так и отталкивания — налицо положительная обратная связь, синергетический эффект. Правда слишком сильно к левому атому он не приблизится из-за обоюдного «дрожания», вызванного тепловым механическим возбуждением вещества и сил отталкивания, возникающих при сближении элементарных частиц на слишком близкое расстояние.
Теперь обратимся к правому атому, который начал испытывать отталкивание. Изначально он и так обладает большей энергией, позволившей ему преодолеть расстояние Ван-дер-Ваальса. Но теперь со стороны своего бывшего соседа — среднего атома — он испытывает дополнительное отталкивание, ещё более ускоряющее его. В результате его энергия дополнительно возрастает за счёт энергии среднего атома. Этот момент перераспределения энергии между «остающимся» средним атомом и «отчаливающим» правым очень важен — именно так отбирается у твёрдой фазы и передаётся жидкой фазе вещества дополнительная энергия, — это тот самый механизм, который обеспечивает ненулевую теплоту плавления и стабильность температуры во время плавления и кристаллизации! При этом излишек энергии «тепловой дрожи» выводится из твёрдой фазы и «прячется» в виде потенциальной энергии отталкивания в жидкой фазе, что более подробно рассматрено чуть ниже.
Энергия плавления
Зная молекулярную массу и удельную теплоту плавления вещества, можно определить, сколько энергии надо одной его молекуле для такого изменения, а также сравнить эту энергию с энергией квантов теплового излучения при соответствующей температуре. Данные по более чем двум десяткам различных веществ сведены в таблицу, которая для компактности изложения вынесена на отдельную страницу.
Из таблицы следует, что соотношение энергии квантов при температуре плавления к теплоте плавления, приведённой к одной молекуле, определяется типом молекулярных связей в веществе — для плавления ковалентных требуется от 0.68 до 1.33 кванта (в среднем 1.05), а для металлических связей — лишь от 0.14 до 0.47 кванта (в среднем 0.26). Это можно объяснить тем, что при металлическом типе связей, характерном для веществ, состоящих из однородных атомов, при высокой температуре достаточно добавить лишь немного энергии, после чего межатомное расстояние превысит критическое, а атомы при этом отделяются по одному. Ковалентные связи, как правило, образуются в веществах с молекулами из разнородных атомов, в которых при плавлении отделяются от «тверди» не атомы, а молекулы, причём обладающие зачастую весьма сильной поляризацией. Неудивительно, что для «растаскивания» таких молекул требуется больше энергии. К тому же металлическая связь, как правило, обеспечивает гораздо лучшую теплопроводность веществ по сравнению с ковалентной. А это значит, что выравнивание локальных неоднородностей энергии происходит более эффективно, и вещество в целом может ближе подойти к порогу плавления, сохраняя «твердотельные» свойства.
Практически во всех случаях в пересчёте на одну молекулу энергия квантов максимума излучения при температуре плавления существенно превышает необходимую для плавления энергию. Это означает, что сам процесс плавления не связан с непосредственным поглощением квантов молекулами, а происходит за счёт общего возбуждения вещества, то есть не является квантовым — для перехода в новое состояние достаточно лишь небольшой «добавки» энергии. Впрочем, как раз это утверждение не ново. Примерно то же утверждала и «старая добрая» МКТ, хотя механизмы этого процесса предполагались несколько иными.
Температура плавления
О различии температур плавления
Логично задаться вопросом: почему вещества, содержащие одинаковые атомы, но в разных пропорциях (например, разные органические вещества), имеют столь разные температуры плавления? Ответ заключается в том, что они имеют разную конфигурацию молекул, а потому и разные межатомные расстояния в кристаллической решётке, и разную силу межмолекулярного взаимодействия. Следовательно, для разрушения таких связей необходимо разное дополнительное возбуждение.
С другой стороны, можно сказать, что взаимодействие с прочими атомами в составе молекулы, безусловно, оказывает влияние на внутреннее возбуждение составляющих её атомов, и, чтобы изменить межмолекулярные связи до степени, делающей невозможным существование вещества в твёрдом виде, разным веществам необходима разная дополнительная энергия. То есть даже для веществ, образованных одинаковыми атомами, если эти атомы объединены в разные молекулы, температуры плавления будут различаться из-за разности молекулярных конфигураций и обусловленных этим различий внутри- и межмолекулярной энергоёмкости и энергообмена.
Стабильность температуры плавления
Ещё один вопрос. Из рассмотренного выше механизма следует, что при плавлении отделившиеся атомы и молекулы получают дополнительную кинетическую энергию, а значит и температура жидкой фазы должна быть выше, чем у твёрдой фазы. Однако со школы всем известно, что несмотря на подвод (или отвод) энергии во время фазового перехода температура сохраняется стабильной до полного завершения этого процесса. Почему это происходит?
Дело в том, что «лишняя» энергия жидкой фазы запасается в виде потенциальной энергии взаимного отталкивания молекул жидкости, а такая «постоянная» потенциальная энергия не проявляется в виде температуры, в отличии от энергии, находящейся в «переменной» форме — в виде волн механических напряжений. С непривычки это может быть трудно для восприятия, но вот пример из электромагнетизма — для излучения энергии (генерации радиоволн) необходимо именно переменное электромагнитное поле, а постоянные электростатические и магнитные потенциалы таких волн не генерируют и энергию вовне непосредственно не излучают — именно поэтому постоянные магниты и заряды существуют без подкачки энергии в течение длительного времени, не теряя своих свойств, а колебательным электромагнитным контурам необходима постоянная подпитка для компенсации излучённой энергии.
Таким образом энергия, затраченная на «раздвигание» атомов и молекул при плавлении, остаётся скрытой для температуры и проявится лишь при обратном фазовом переходе, когда, наоборот, резкое сближение частиц вещества будет порождать в его объёме ударные нано-волны, способные проявиться в виде теплового излучения.
К тому же следует заметить, что температура остаётся стабильной только тогда, когда приток или отток энергии настолько мал, что теплопроводность вещества позволяет распределить изменение энергии по всему его объёму практически равномерно. Если это не так, температуры жидкой и твёрдой фаз будут различаться (пример — самая обычная электросварка, где возле дуги металл жидкий и даже кипящий, а буквально в нескольких миллиметрах — вполне твёрдый).
Наконец, «истинные» плавление-кристаллизация со стабильной температурой наблюдаются преимущественно у веществ с простыми молекулами. Для веществ со сложными молекулами (прежде всего это органические вещества) более характерен постепенный переход между жидким и твёрдым состояниями, когда разница температур «определённо-жидкого» и «определённо-твёрдого» состояний может составлять многие градусы и даже десятки градусов, а в промежутке между ними агрегатное состояние вещества также является промежуточным. В этом случае преобладающим механизмом плавления, по всей видимости, является именно постепенное уменьшение межмолекулярного притяжения из-за увеличения размеров атомов и молекул в связи с их внутренним тепловым возбуждением.
Кристаллизация
То, что теплота кристаллизации равна теплоте плавления, неудивительно и интуитивно понятно — в самом деле, сколько энергии было затрачено при «раздвижке» молекул во время плавления, столько же её должно вернуться при их сближении во время кристаллизации. Однако из вышеописанного механизма плавления следует, что для кристаллизации молекулы вещества должны сблизиться на расстояние меньшее, чем расстояние Ван-дер-Ваальса, а для этого температура должна опуститься гораздо ниже, чем температура плавления. Всё правильно, и так оно и есть, — это явление давно и хорошо известно под названием «переохлаждённые жидкости», когда жидкое состояние сохраняется при температурах, заметно меньших обычной температуры плавления-кристаллизации. Как правило, это должны быть особо чистые и однородные жидкости, охлаждаемые очень плавно и хорошо защищённые от внешних воздействий, в том числе механических. Как только эти условия нарушаются (скажем, ёмкость с такой жидкостью испытывает толчок), они тут же кристаллизуются, при этом их температура за счёт теплоты кристаллизации повышается, и если она успевает достичь температуры плавления, то остаток такой жидкости кристаллизуется «как обычно», при температуре плавления.
Центры кристаллизации
Общепризнанным является тот факт, что кристаллизация начинается не сразу по всему объёму расплава, а в некоторых точках, называемых «центрами кристаллизации». В качестве таких центров могут выступать различные включения, пузырьки, стенки сосуда и другие неоднородности. Каков же физический смысл этих центров?
А физический смысл очень прост — для того, чтобы вещество перешло из жидкого в твёрдое состояние, его молекулы должны сблизиться на расстояние, меньшее расстояния Ван-дер-Ваальса, однако сила отталкивания даже охлаждённых «сжавшихся» (или «меньше дрожащих») молекул не позволяет это сделать, поэтому необходим внешний толчок, дополнительная «концентрация» энергии. Дать такой избыток энергии может броуновское движение твёрдого включения или локальная неоднородность самого расплава, возникшая или из-за механического толчка, или из-за завихрения потока жидкости при её движении с конвективным или механическим побуждением.
Следует заметить, что для простейшей кривой взаимодействия, имеющей монотонный характер в области смены знака силы взаимодействия, добиться переохлаждения жидкости практически невозможно, так как малейший дисбаланс расстояний до соседей ведёт к увеличению отталкивания с более дальним соседом и уменьшению отталкивания с ближним, что ещё больше способствует увеличению разности расстояний — до тех пор, пока ближние соседи не войдут в зону притяжения, превратившись в фрагмент твёрдого вещества. Поэтому переохладить удастся не любую жидкость. А вот для воды, расширяющейся в момент замерзания, такое состояние вполне возможно и многократно подтверждено экспериментально. Тем не менее, для всех жидкостей локальные неоднородности способствуют первоочередному протеканию кристаллизации за счёт создания бóльших «перекосов», нежели в однородной жидкости.
Стабильность температуры кристаллизации
Механизм, который обеспечивает стабильность температуры при дополнительном энерговыделении во время кристаллизации, является как бы зеркальным отражением механизма энергопоглощения при плавлении. Как уже говорилось выше, при снижении возбуждения частица жидкости приближается к своему ближайшему соседу — сначала из-за меньшего отталкивания, а затем и из-за нарастающего притяжения. В соответствии с кривой взаимодействия более дальние частицы, расстояние до которых возрастает, испытывают возрастающее отталкивание «кристаллизующейся» частицы, за счёт чего увеличивается их импульс, скорость относительно среды, а следовательно, и энергия. В то же время частица, притягивающаяся из расплава к твёрдой фазе, «ударяется» об уже кристаллизовавшиеся частицы, передавая им свой импульс и порождая в этой фазе «тепловую» ударную волну. Эта энергия поднимает общую энергию кристаллизовавшегося фрагмента вещества, в случае отсутствия теплообмена с внешней средой давая возможность ему снова частично расплавиться и сохраняя равновесие между жидкой и твёрдой фазами. Если же имеется теплоотвод во внешнюю среду, то твёрдая фаза образуется именно в месте наибольшего теплоотвода, и передача ей этой «лишней» энергии «прилипшей» частицы повышает её теплоту и поддерживает общую температуру кристаллизующегося вещества на одном и том же уровне, невзирая на отток энергии. Таков механизм преобразования «скрытой» потенциальной энергии взаимного отталкивания частиц жидкости в «тепловую» энергию кристаллизовавшейся части вещества.
Вещество в окрестностях точки плавления
При прочтении всего вышесказанного возникает вопрос — неужели же переход между твёрдым и жидким состояниями происходит столь резко и все описанные явления происходят именно при температуре плавления? Конечно, нет!
По мере повышения температуры отдельные молекулы переходят в «жидкое» состояние задолго до достижения температуры плавления. Однако их энергия слишком сильно отличается от «средней по веществу», а потому за счёт механизмов теплообмена почти мгновенно распределяется между их ближайшими соседями, тут же возвращая эти частицы в «твёрдое» состояние. На макроуровне это проявляется как повышение пластичности твёрдых веществ, особенно заметно возрастающей по мере приближения температуры к точке плавления.
Наоборот, по мере понижения температуры жидкости и её приближения к температуре кристаллизации, некоторые молекулы могут потерять часть своей энергии, излучив тепловой квант или оказавшись в локальном «узле» механической волны, и при этом оказаться достаточно близко друг к другу, чтобы испытать взаимное притяжение. Однако общий запас энергии у вещества ещё достаточно велик, и механизмы теплообмена тут же «добавят» этим молекулам недостающую энергию, разорвав ещё непрочные взаимные связи. На макроуровне это проявляется как существенное повышение вязкости жидкости по мере приближения температуры к точке кристаллизации.
Наконец, при самой температуре плавления-кристаллизации существует динамическое равновесие между твёрдой и жидкой фазами. Какой фазы будет больше, определяется тем, сколько внутренней энергии имеется в веществе — если её много, то преобладать будет жидкая фаза, а если относительно мало — то твёрдая.
Аномалии при плавлении и кристаллизации
Вышеописанные механизмы объясняют поведение при плавлении и кристаллизации большинства веществ, у которых в окрестностях температуры плавления объём твёрдой фазы обычно на несколько процентов меньше объёма жидкой. С ними всё понятно — в твёрдой фазе атомы и молекулы «упакованы» плотнее, связи между ними короче, потому и объём этой фазы меньше. Однако из этого правила существует несколько исключений, и среди них самое распространённое и самое яркое — обычная вода, у которой плотность твёрдой фазы примерно на 10% меньше плотности жидкой! В чём же здесь дело?
А дело здесь заключается в том, что в силу особенностей молекул воды, вызванных их крайне малыми размерами в сочетании с высокой поляризацией, образование жёсткой связи из-за притяжения взаимно ориентирует молекулы таким образом, что они вынуждены образовывать ажурные структуры, преимущественно шестигранные (считается, что, пребывая в виде льда, каждая молекула воды имеет 4 водородные связи — две из них обеспечивает пара атомов водорода, а две — атом кислорода). Такие ажурные структуры имеют много пустого пространства в середине, за счёт чего объём воды при замерзании заметно возрастает, однако энергетическая выгодность таких связей, вызванная сильным взаимным притяжением атомов, превышает потери, связанные с необходимостью увеличения объёма. Кстати, именно столь высокая сила этих связей и обуславливает аномально высокую теплоту плавления-кристаллизации у воды.
Однако полученные ажурные конструкции оказываются весьма хрупкими, и для того, чтобы их сломать, достаточно относительно невысокой температуры, то есть возбуждения молекул. В результате молекулы, не имея жёсткой связи друг с другом, «упаковываются» плотнее, заполняя ранее неиспользованное пространство в серединах шестигранников. При этом «ломаются» многие связи, но не все. Часть связей продолжает «доламываться» уже при более высокой температуре (конечно, в реальности они не сохраняются неизменными со времён твёрдой фазы, а постоянно создаются и разрушаются, просто вероятность их создания и существования в течении длительного времени ещё остаётся достаточно высокой — это процесс динамический). Поэтому после плавления вода плотность воды по мере роста температуры продолжает увеличиваться из-за всё меньшего количества таких связей. Наконец, при достижении 4°С образование таких замкнутых структур с пустотой в центре становится практически невозможным, — при этой температуре плотность воды максимальна и по мере дальнейшего нагрева начинает снижаться из-за температурного расширения — увеличения межмолекулярных расстояний, вызванного ростом теплового движения молекул. Исходя из вышесказанного, неудивительно, что с ростом внешнего давления температура наибольшей плотности воды снижается — избыточное внешнее давление помогает «сломать» такие объёмные структуры раньше. Традиционно считается, что эти связи продолжают рваться вплоть до испарения воды, но на самом деле это не так — ведь между частицами жидкости нет притяжения, а есть лишь взаимное отталкивание. Впрочем, «осколки» таких структур ещё могут существовать вплоть до 42°С — температуры, соответствующей наименьшей теплоёмкости воды (именно энергия этих связей обуславливает относительно большую теплоёмкость воды при низких температурах). Но эти осколки уже разрушаются раньше, чем успевают вырасти и замкнуться, а потому они плотно «упаковываются» среди других молекул воды и не оказывают заметного влияния на её плотность, проявляясь лишь в виде аномального повышения теплоёмкости при относительно низких температурах.
Жидкое агрегатное состояние вещества
Жидкость — самое необычное состояние вещества. И главное его своеобразие заключается в том, частицы жидкости испытывают взаимное отталкивание, но продолжают оставаться вместе. Поэтому для стабильного существования вещества в жидком состоянии необходимо внешнее давление не ниже определённой величины, определяемой составом вещества и температурой, в противном случае жидкость сразу превратится в пар! Кстати, по этой же причине многие аспекты испарения и конденсации придётся рассматривать уже здесь, а не в посвящённом им разделе — ведь жидкость почти никогда не существует отдельно от своих паров.
Объяснение основных свойств жидкости
Механизм обеспечения жидкого состояния
Каков же механизм, обуславливающий сохранение жидкого состояния вещества в окружении газовой атмосферы с определённым давлением? Почему взаимно отталкивающиеся частицы жидкости не разлетаются в разные стороны немедленно? Потому, что с частицами окружающей их газовой среды они испытывают ещё большее отталкивание, чем между собой, так что держаться вместе, рядом друг с другом, им энергетически выгодно. Сжимаемые внешней средой, они находятся на очень близких расстояниях друг от друга, — эти расстояния лишь ненамного отличаются от межмолекулярных расстояний в твёрдых кристаллах. Поэтому молекулы жидкости ориентированы не хаотически, а с учётом формы и ориентации своих соседей, а те, в свою очередь, — соседей соседей и так далее, образуя те самые псевдокристаллы с достаточно строгим внутренним «ближним порядком», существование которых в жидкостях уже давно стало общепризнанным. Однако в отличии от «твёрдых» кристаллов, где атомы связаны силами взаимного притяжения, в жидкостных псевдокристаллах элементы испытывают слабое взаимное отталкивание. Поэтому достаточно любого более-менее значимого повода, чтобы частицы жидкости «проскользнули» друг по другу — жидкость течёт. Да и взаимное отталкивание по сравнению с притяжением даёт больше степеней свободы в плане возможной ориентации частиц жидкости. Образно говоря, «твёрдый» кристалл можно сравнить со стенкой, сложенной из кирпичей, скреплённых цементом, которая все внешние воздействия воспринимает как единое целое, а «жидкий» псевдокристалл — с такой же стенкой, но сложенной «всухую», без раствора — она менее прочная, зато кирпичики в ней имеют бóльшую свободу, и до определённого предела она даже может изгибаться и колебаться без разрушения.
При повышении температуры усиливается и «тепловое дрожание» молекул, расстояния между ними увеличиваются, а межмолекулярные силы отталкивания внутри жидкости возрастают. Этому способствуют и всё менее тесные ограничения свободы со стороны ближайших соседей. Плотность жидкости уменьшается. Наконец, когда силы межмолекулярного отталкивания внутри жидкости сравняются с силой отталкивания между частицами жидкости и атмосферы, происходит массовое испарение жидкости, то есть кипение.
Жидкое состояние вещества на кривой взаимодействия
Теперь рассмотрим особенности жидкого состояния вещества с помощью кривой взаимодействия.
 Особенности жидкого состояния вещества на кривой взаимодействия (межмолекулярное расстояние d зависит от температуры вследствие теплового расширения).
Принципиальной возможности существования вещества в жидком состоянии соответствует участок кривой взаимодействия от точки смены знака силы взаимодействия до точки экстремума — наибольшей силы взаимного отталкивания. На этом участке увеличение расстояния между объектами ведёт к увеличению силы отталкивания, то есть как бы энергетически невыгодно. Однако именно «как бы» — ведь объекты всё равно испытывают взаимное отталкивание, а потому стремятся быть друг от друга как можно дальше. И лишь внешние факторы, препятствующие их неограниченному разлёту и способные удержать систему в равновесии (статическом или динамическом), могут «проявить» энергетическую невыгодность расстояний с повышенной силой отталкивания и обеспечить разделение вещества на одновременно сосуществующие газовую и жидкую фазы. В подавляющем большинстве случаев в качестве такого фактора выступает внешнее давление — именно оно определяет температуру кипения, т.е. активного испарения.
Псевдокристаллы и жидкостное трение
Псевдокристаллы и струйки
Взаимное отталкивание молекул обеспечивает изменчивость формы, текучесть жидкости, а внешнее давление — её пребывание не в газообразном, а именно в плотном жидком состоянии. Однако очевидно, что плотная упаковка частиц способствует высокой степени их упорядоченности. Правда, вместо принципа максимального притяжения, характерного для твёрдого состояния вещества, упорядоченность в жидкости определяется принципом наименьшего взаимного отталкивания. Впрочем, на результат это различие влияет мало, упорядоченность лишь становится менее жёсткой и однозначной. Потому и «кристаллы» жидкости имеют расплывчатые, постоянно меняющиеся границы. Можно сказать, что между ними нет чётких границ, и они плавно переходят друг в друга. В неподвижной жидкости трудно сказать, где начинается один псевдокристалл и кончается другой, но ориентация «решёток» в отстоящих друг от друга точках существенно различается.
Значит ли это, что в жидкости нет сил межатомного притяжения? Нет, не значит. Такие силы могут преобладать внутри элементов псевдокристаллов — молекул жидкости и гидрат-ионов, — но между элементами самого псевдокристалла преобладают силы отталкивания.
В реальной жизни в силу тех или иных обстоятельств соседним частицам всегда в одних местах немного легче сдвинуться друг относительно друга, чем в других. И как только жидкость начинает двигаться, именно в этих местах нарушается ближний порядок и слои жидкости сдвигаются, разделяя псевдокристаллы по самым слабым звеньям. В результате в подвижной жидкости образуются струйки, характерный размер которых определяется средним расстоянием между такими «слабыми» местами. Поэтому понятие струйки имеет вполне определённый физический смысл — это часть жидкости, движущаяся в одном направлении и с одной скоростью, поскольку внутри неё частицы взаимодействуют между собой сильнее, чем с соседними струйками, то есть элементарная струйка — это псевдокристалл в движении, и в отличии от неподвижной жидкости здесь его границы вполне определены (я использую именно уменьшительный термин «струйка», чтобы отличить элементарную струйку-псевдокристалл от их более крупных совокупностей, которые называются струями — именно они обычно и соответствуют повседневному смыслу этого понятия).
Поскольку, как правило, относительное ослабление связей (вернее, возрастание взаимного отталкивания) вызвано текущим положением частиц в результате их «тепловой дрожи», места точек «потенциального разрыва» перемещаются по объёму жидкости случайным образом, обеспечивая изменчивость струй. Но, конечно, там где разрыв уже произошёл — на границе струек — связи ослаблены в наибольшей степени, и этот факт обеспечивает относительную стабильность струек.
Вязкость, жидкостное трение и сверхтекучесть
Хотя взаимное отталкивание и обеспечивает подвижность жидкости, её молекулы не могут двигаться свободно и независимо друг от друга. Наоборот, малое расстояния между частицами жидкости обуславливает их весьма сильное взаимовлияние, по своей эффективности близкое к прямому механическому контакту. В результате движение любой частицы жидкости неизбежно сопровождается расталкиванием и вовлечением в своё движение ближайших соседей, а вынужденное движение этих соседей вовлекает в процесс и более удалённые частицы — так что заметно возмущённой оказывается достаточно обширная область окрестностей инициатора движения. Однако отсутствие жёстких связей между частицами обеспечивает постепенное затухание этого возмущения по мере удаления от его центра, поэтому в движение вовлекается лишь часть объёма жидкости, а не вся жидкость независимо от её объёма, как это имеет место в случае твёрдых веществ с жёсткими связями между молекулами.
Очевидно, что подобное возмущение соседних частиц требует затрат энергии, которые вызывают потери кинетической энергии инициатора движения и его торможение. Таков основной механизм вязкости — главной причины жидкостного трения. Однако когда жидкость состоит из больших молекул сложной формы, они могут «переплетаться» между собой, и для взаимного движения им надо не просто «растолкать» соседей, но ещё и «разогнуть» часть своих и чужих изгибов. При этом жёсткость формы молекулы очень сильно зависит от межатомного расстояния, определяемого текущей температурой вещества — уже небольшое увеличение межатомной дистанции резко уменьшает усилия, необходимые для «разгибания» молекулы. Поэтому вязкость таких жидкостей зависит от температуры гораздо сильнее, чем у жидкостей с простыми молекулами, — вплоть до перехода к почти твёрдому состоянию при температурах, когда молекулы ещё не притягиваются друг к другу — лишь за счёт «отвердения» формы молекул (например, если в диапазоне от 10 до 70°С вязкость бензола падает в 2.2 раза, воды — в 3.2 раза, анилина — в 5.1 раза, то трансформаторного масла — в 11 раз, а касторового масла — в 50 раз). Для жидкостей с простыми молекулами, типа воды, главным фактором падения вязкости с температурой является увеличение межмолекулярных расстояний, вызванное тепловым расширением — «расталкивать» уже можно не так сильно, и энергии на это тратится меньше.
При движении жидкости вдоль стенки, состоящей из твёрдого вещества, она также взаимодействует и с частицами стенки. При этом в разных точках сила взаимодействия меняется, испытывая минимумы и максимумы отталкивания. Естественно, что для частиц жидкости наиболее энергетически выгодно находиться в точках, соответствующих минимуму отталкивания. Поскольку
частицы стенки неподвижны, неподвижны и точки этих энергетических минимумов. Но воздействие более удалённых и активно движущихся частиц заставляет двигаться и ближайшие к стенке частицы (или, если смачиваемость очень хорошая — частицы жидкости из ближайших к стенке слоёв). В результате они движутся как бы по «стиральной доске» из минимумов и максимумов энергии взаимодействия. Естественно, такое движение требует затрат энергии, на макроуровне проявляющихся в виде потерь на гидравлическое трение. На что уходит эта энергия? Дополнительная макроскорость (общая скорость потока) увеличивает амплитуду «тепловой дрожи», то есть локальные колебательные возмущения как в жидкости, так и в стенке, тем самым повышая их температуру, и таким образом кинетическая энергия потока переходит в тепло.
Интенсивность такого дополнительного возмущения определяется относительной скоростью соседних слоёв, и чем плавнее распределён градиент скорости по сечению потока жидкости, тем меньше эти потери. Но есть и другой вариант снижения потерь, когда соседние слои движутся друг относительно друга таким образом, что их колебания попадают в резонанс и потому почти не мешают друг другу. Первый случай соответствует ламинарному течению, второй — турбулентному (именно попытки соседних молекулярных слоёв потока автоматически подстроиться под резонансные условия и вызывают закручивание струй). Результаты измерения скорости потока профессором Поппелем наглядно подтверждают этот механизм — там явно просматриваются минимумы и максимумы сопротивления, соответствующие оптимальным и неоптимальным режимам подстройки. Наличие оптимальных и неоптимальных режимов течения просматривается и в результатах, полученных Котоусовым.
Важное значение имеет материал стенок трубы, так как в силу своей статичности и неподвижности именно они задают особенности движения жидкости. Очевидно, что наиболее просто достигнуть резонанса при абсолютно регулярном строении материала стенок, а это легче всего обеспечить, изготовив стенки из чистого металла с минимумом примесей — так изготавливаются медные водопроводные трубы. Сталь представляет собой железо с довольно большим содержанием углерода, и потому нано-структура стенок стальных труб (на уровне молекул) уже далека от идеальной. Стекло также имеет весьма разнородную структуру. В связи с электродинамическим характером взаимодействия неудивительно, что движение жидкости может сопровождаться разделением зарядов и электризацией как стенок трубы, так и слоёв жидкости. Как правило, электризация также тормозит поток. Поэтому электропроводность материала стенок тоже может влиять на общее гидравлическое сопротивление.
Можно ли достигнуть нулевого или близкого к нулевому гидравлического сопротивления? Результаты опытов Поппеля позволяют предположить, что да. Физической основой этого является оптимальная настройка течения по всему сечению потока. Возможно ли получить таким образом дополнительное ускорение, то есть сверхъединичность? За счёт чисто механических причин — нет! И наконец, следует отметить, что в данном случае речь идёт не о сверхтекучести как таковой, а лишь об отсутствии (или резком снижении) гидравлического сопротивления потоку. «Истинная» низкотемпературная сверхтекучесть, наблюдаемая, скажем, у жидкого гелия, имеет совсем другую природу и другие проявления, не сводящиеся к одному лишь отсутствию сопротивления движению жидкости. Кстати, мне не удалось найти сведений о равновесии между паром и жидкой фазой для низкотемпературных сверхтекучих жидкостей, а это было бы весьма интересно!
Поддержание равновесия между жидкостью и паром
Теперь детально рассмотрим механизмы, обеспечивающие жидкое состояние вещества. Существует два важнейших случая — двухкомпонентная система, когда имеется лишь одно вещество, часть которого находится в газообразном, а часть в жидком состоянии, и трёхкомпонентная система, когда к этим двум компонентам добавляется химически невзаимодействующий с ними газ.
Поддержание жидкого состояния в двухкомпонентной системе
Сначала рассмотрим систему, состоящую из двух компонентов — жидкости и её паров, находящихся в ограниченном объёме.
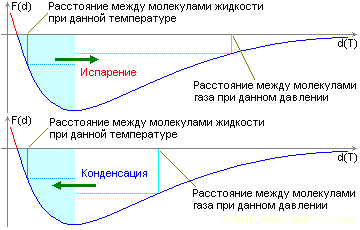 Схема поддержания равновесия между жидкой и газообразной фазой одного и того же вещества в замкнутом объёме (двухкомпонентная система). На верхнем рисунке — давление слишком низкое или температура слишком высока, на нижнем рисунке, наоборот, давление слишком высоко или температура слишком низка для равновесного состояния.
Предположим, что в пустой сосуд (абсолютно пустой — там вакуум) поступает порция жидкости. Поскольку частицы жидкости испытывают взаимное отталкивание, они тут же устремляются в пустое пространство, ведь там ничто не препятствует их распространению. Постепенно их концентрация в бывшей пустоте растёт, расстояние между ними уменьшается, возрастает и давление. Однако, пока сила взаимного отталкивания в жидкости превосходит силу взаимного отталкивания в газе, процесс испарения продолжается, хотя и менее интенсивно. Массовое испарение прекратится только тогда, когда силы взаимного отталкивания в жидкости и в газе сравняются. При этом определяющей является сила отталкивания в жидкости, которая зависит от расстояния между частицами, а оно, в свою очередь, определяется температурой жидкости. То есть в данном случае весь процесс задаётся температурой жидкости в сосуде, и связь между давлением и этой температурой однозначна.
Теперь представим, что давление пара вдруг возросло (допустим, сосуд был оборудован поршнем, с помощью которого мы уменьшили объём экспериментального отсека). При этом с ростом давления межмолекулярные расстояния в жидкости практически не изменились (недаром жидкости слабосжимаемы), не изменилась и сила межмолекулярного отталкивания. А вот в газовой фазе межмолекулярные расстояния уменьшились заметно, а соответственно возросла и сила отталкивания. В результате «лишние» молекулы газовой фазы «выталкиваются» в жидкость или сближаются между собой, образуя капельки — происходит процесс конденсации, так как в жидкости силы отталкивания получаются меньше, чем в сжатом паре, и жидкое состояние оказывается энергетически более выгодным за счёт меньшей потенциальной энергии взаимодействия. При переходе части пара в компактную жидкость его количество уменьшается, давление падает, и процесс продолжается до тех пор, пока не наступит равновесие. Как и в предыдущем случае, определяющим фактором здесь является сила взаимного отталкивания частиц в жидкости, которая зависит от её температуры. Связь между давлением паров и температурой также однозначна.
А что происходит в состоянии равновесия? Как правило, это равновесие динамическое — часть молекул жидкости из-за неравномерности среды (возникающей в силу разных причин, прежде всего в газовой фазе) может получить оказаться с избытком скорости и перейти из жидкости в пар. Тогда для компенсации микропревышения давления в скором времени такое же количество частиц переходит из пара в жидкость. Аналогично, имеет место и обратный процесс — излишняя микроконденсация, компенсируемая затем микроиспарением. Однако если эту систему оставить в покое, постепенно скорости выровняются, и их уже будет не хватать, чтобы сколько-нибудь существенное количество молекул смогло преодолеть зону «повышенного отталкивания» — своеобразный потенциальный барьер между паром и жидкостью. Равновесие приближается к статическому. И вот тут при изменении температуры (опять же, очень плавном — чтобы на границе не возникли существенные неоднородности, увлекающие молекулы за собой и тем самым позволяющие им пройти этот барьер) создаются условия для получения переохлаждённого пара или перегретой жидкости.
Таким образом, в двухкомпонентной системе «пар-жидкость» равновесное состояние определяется температурой жидкости, которой соответствует строго определённое давление паров, однозначно задаваемое кривой взаимодействия. Если давление ниже, то происходит испарение, причём этот процесс имеет место во всём объёме жидкости, хотя наиболее интенсивно он происходит, естественно, на границе раздела сред. Если давление так и не достигнет уровня, соответствующего температуре жидкости, жидкость испарится полностью. Наоборот, повышение давления или понижение температуры вызывает интенсивную конденсацию и переход части пара в жидкое состояние.
Поддержание жидкого состояния в трёхкомпонентной системе
Теперь добавим к нашим двум компонентам — жидкости и пару — химически не взаимодействующий с ними газ. В результате получим трёхкомпонентную систему жидкость-пар-газ, которая как раз и соответствует наиболее часто встречающейся в окружающем нас мире ситуации, например системе «вода — водяной пар — воздух».
Итак, подадим жидкость в сосуд, уже содержащий под определённым давлением «сухой» газ (то есть газ, в котором нет сколько-нибудь существенного количества вещества, составляющего подаваемую жидкость). Хотя в первый момент газообразная фаза вещества жидкости практически отсутствует, в отличии от предыдущего случая резкого испарения с бурным парообразованием не произойдёт. Почему? Потому что давление газа препятствует столь бурному протеканию процесса на поверхности жидкости, стремясь «не пустить» её частицы в свободный полёт, и полностью предотвращает парообразование внутри объёма жидкости, не давая там повода её частицам слишком сильно отдаляться друг от друга.
Однако некоторые молекулы под влиянием флуктуаций тепловых механических напряжений, а также механического воздействия частиц газа, всё равно могут покинуть поверхность жидкости и перейти в атмосферу — жидкость постепенно испаряется. Этот процесс продолжается до тех пор, пока количество испаряющихся молекул жидкости не уравновесится с количеством возвращающихся в неё молекул. А здесь условия те же самые, что и для только что рассмотренной двухкомпонентной системы «жидкость-пар». Поэтому при относительно небольших давлениях газа установившееся парциальное давление паров жидкости при одной и той же температуре будет почти одинаковым что в двухкомпонентной, что в трёхкомпонентной системе. Но из-за дополнительного воздействия на жидкость частиц газа оно всё же не одинаково, что становится заметным с ростом давления газа.
Динамический баланс у поверхности жидкости
Поскольку барьер между жидкостью и газом обусловлен не силами притяжения-отталкивания, а балансом одних лишь сил отталкивания, то необходимым условием поддержания жидкого состояния является присутствие достаточного количества молекул газа вблизи границы жидкости. Однако молекулы газа испытывают выраженное тепловое движение, и потому их расстояние как между ними, так и от края жидкости до ближайшей к нему молекулы газа всё время изменяется в весьма широких пределах.
 Флуктуации локального давления вследствие теплового движения и вызванные этим испарение и конденсация.
А раз расстояние всё время разное, то всё время меняется и сила отталкивания между крайними частицами жидкости и газа. В результате, когда в своём достаточно хаотическом движении (даже при его глобулярном характере) частицы газа временно удаляются на слишком большое расстояние от данной точки поверхности жидкости, сила отталкивания со стороны газа, действующая на крайнюю молекулу в этом месте, становится меньше, чем сила отталкивания со стороны жидкости, и эта молекула начинает удаляться от границы жидкости в область газовой фазы. И если она удалится на расстояние, соответствующее максимуму отталкивания, то она перейдёт потенциальный барьер и в любой ситуации ей уже будет энергетически выгодно наращивать расстояние до других частиц, то есть эта частица перейдёт в газовую фазу, испарится.
Однако возможна и обратная ситуация — вследствие того же хаотического движения достаточно энергичные частицы газа соберутся в одном месте и «надавят» на ближайшую к жидкости частицу газа с такой силой, что она приблизится к поверхности жидкости на расстояние, меньшее дистанции максимальной силы отталкивания. Тогда, при условии, что давление со стороны молекул газа продолжит сохраняться на достаточно высоком уровне ещё некоторое время, «вдавленной» частице будет энергетически выгодно приблизиться к жидкости и «слиться» с ней — произойдёт конденсация.
Так обеспечивается постоянное динамическое равновесие между жидкой и паровой фазами у поверхности жидкости. Кстати, необязательно «отщепление» молекул по одной. Вполне вероятно, что в результате «тепловой дрожи» поверхность «наибольшего отталкивания» пройдёт на некотором расстоянии от крайнего слоя жидкости, тогда от жидкости оторвётся и испарится не одна молекула, а сразу несколько — своего рода нано-капелька. Однако размеры этой капельки никогда не будут слишком большими. Причин этому две. Во-первых, локальные флуктуации давления, вызванные тепловым движением частиц газа, имеют очень малые размеры, исчисляемые единицами средних межмолекулярных расстояний в газовой фазе и даже долями таких расстояний. Во-вторых, масса оторвавшейся капельки должна быть очень малой, чтобы её инерционность не помешала ей успеть набрать достаточную скорость и удалиться на необходимое расстояние за более чем короткое время существования флуктуации давления.
Как предотвратить испарение
Можно ли получить жидкость, которая бы практически не испарялась? Можно, если сила взаимного отталкивания её молекул будет близка к нулевой. Допустимо даже некоторое взаимное притяжение между отдельными участками молекул, однако менее сильное, чем отталкивание соседних участков этих же молекул. Это вполне возможно у молекул больших размеров, характерных для разных органических веществ. При этом очевидно, что если притяжение становится достаточно сильным, то молекулы слипнутся — вещество затвердеет. Однако увеличение теплового движения по мере нагрева способно разорвать эти связи — вещество будет постепенно увеличивать подвижность без выраженной температуры плавления. Именно такое поведение наблюдается у многих органических веществ, в частности масел.
Есть и другая теоретическая возможность организовать трёхкомпонентную систему, в которой жидкость бы практически не испарялась. Для этого надо найти такой газ, чтобы взаимное отталкивание его частиц и частиц жидкости намного превышало силу отталкивания частиц жидкости между собой. Но этого мало — частицы такого газа должны располагаться достаточно плотно, чтобы частицы жидкости не смогли «проскочить» между ними, то есть давление газа должно быть весьма высоко. Наконец, тепловое движение и в газе, и в жидкости должно быть настолько слабым, чтобы ни у тех, ни у других не хватало энергии для преодоления потенциального барьера на границе, т.е. температура системы должна быть достаточно низкой. Следует признать, что условия достаточно экзотические и в окружающем нас мире практически не встречаются. Однако подобные процессы имеют место и на границах жидкости с твёрдыми веществами, определяя такую важнейшую характеристику их взаимодействия, как смачиваемость.
Смачиваемость и растворяемость
Всем известно, что одна и та же жидкость может хорошо смачивать одни поверхности, обволакивая их и даже поднимаясь на значительную высоту против силы тяжести, и очень плохо смачивать другие, отказываясь растекаться по ним и собираясь в крупные капли. Этот эффект зависит от сочетания жидкости с материалом поверхности. В чём же дело?
Смачиваемость
Конечно, всё дело в силе взаимодействия между молекулами жидкости и вещества, образующего твёрдую поверхность. Если она отрицательна, но меньше силы взаимного отталкивания молекул жидкости, то жидкость охотно обволакивает такую поверхность, если же взаимное отталкивание внутри жидкости слабее, чем при взаимодействии с поверхностью — жидкость не хочет смачивать её и собирается в капли. Также поверхность вещества будет смачиваться, если жидкость будет испытывать притяжение к её молекулам, но сила этого притяжения будет меньше сил, связывающих молекулы вещества друг с другом.
Растворение и некоторые другие химические реакции
Наконец, если между жидкостью и молекулами поверхности вещества возникает сила притяжения, сравнимая или превосходящая взаимное притяжение молекул вещества между собой, то происходит химическая реакция. Если жидкость — вода, то в случае, когда молекулы воды просто «прилипают» к молекулам вещества, такой процесс называется гидратацией. Крайняя степень гидратации — растворение. Реакция растворения обратима — при высыхании после удаления воды вещество восстанавливает свои исходные свойства. В силу высокой поляризации молекул воды почти всегда растворение в ней сопровождается разрушением молекул вещества на ионы (диссоциацией), однако сами молекулы воды остаются целыми и при удалении из раствора (высыхании) «отваливаются» от прикрепившихся к ним «осколков» вещества — ионов, — которым не остаётся ничего другого, как «слипнуться» обратно в исходные молекулы. Возможна ситуация, когда ранее существовавшие внутримолекулярные связи, в общем, сохраняются, поскольку оказываются более крепкими, чем связи между молекулами вещества и жидкости. Тогда происходит растворение без диссоциации, и получившийся раствор не обладает свойствами электролита.
Кстати, есть достаточно большая группа веществ, которые устойчиво существуют только при наличии в их составе воды. Например, это серная кислота, максимальная концентрация которой не превышает 98%, или алкоголь (этиловый спирт), который нельзя «осушить» более 96%. У этих веществ силы взаимодействия их молекул с водой столь велики, что при относительно низких температурах они «не отпускают» всю воду, а повышение температуры, которое могло бы «отцепить» оставшиеся молекулы воды, разрушительно для молекул самого осушаемого вещества.
Но почему в той же воде одни вещества растворяются хорошо, другие — не очень, а третьи почти не растворяются? Во-первых, растворяются только смачиваемые вещества. Несмачиваемые вещества не растворяются (современные технологии позволяют получить их водные эмульсии, но будучи предоставлены сами себе, по прошествии некоторого времени эти эмульсии снова разделяются на воду и нерастворимое в ней вещество). Во-вторых, всё зависит от соотношения сил взаимодействия и количества молекул воды, необходимых для того, чтобы «оторвать» молекулу вещества от его куска. Если силы невелики, а молекул воды надо мало — вещество растворяется быстро и много. Если же связи более крепкие, растворение происходит медленно и мало. Важную роль в этом играют тепловые колебания молекул. С их усилением по мере роста температуры растворимость обычно сначала улучшается, а затем, когда движение становится слишком активным, падает — тогда происходит выпадение накипи и испарение растворённых газов, поскольку активно двигающиеся молекулы воды просто «стряхивают» прицепившиеся к ним молекулы или ионы вещества. Условия этих процессов индивидуальны для каждой пары «вещество-жидкость».
Но иногда атомам жидкости и вещества оказывается более выгодным образовать новые связи, разорвав старые, а «освободившиеся» атомы, в свою очередь, связываются между собой — тогда происходит «истинная» химическая реакция с образованием новых веществ, часть из которых может покинуть раствор в виде газов или осадка. Школьными примерами таких реакций являются, скажем, «растворение» металлического натрия в воде с образованием щёлочи 2Na + 2H2O → 2NaOH + H2↑ или соединение воды с негашёной известью CaO + H2O → Ca(OH)2↓.
Абсорбция и диффузия газов
Растворение газов в жидкости называется абсорбцией. Этот процесс аналогичен растворению твёрдых веществ — молекулы таких газов испытывают притяжение к молекулам жидкости и потому поглощаются ею в больших количествах, — вплоть до того, что из-за поглощения газа давление в газовой среде может упасть во много раз (именно на этом основана работа абсорбционных холодильников). Обратное разделение, как правило, происходит при нагревании полученного раствора, когда в первую очередь разрушаются связи между молекулами газа и жидкости, а не их внутримолекулярные связи.
Диффузия газов в жидкость принципиально отличается от «истинной» абсорбции — между молекулами жидкости и газа при этом не возникает притяжения, а сохраняется взаимное отталкивание. Оно может быть меньше взаимного отталкивания частиц жидкости, а может быть и больше. В первом случае газ растворяется в жидкости достаточно хорошо, во втором — плохо. Однако попадание газа в жидкость возможно почти всегда — вследствие относительно высокой скорости его молекул в обычных условиях, они могут «пробить» не только поверхностный энергетический барьер жидкости, но и несколько углубиться в неё, а затем их может увлечь глубже тепловое движение в жидкости — то самое, что вызывает всем известное «броуновское движение». Вероятность такого захвата растёт с ростом температуры, а значит, скоростей молекул газа и обусловленной этим вероятности врезаться в жидкость достаточно глубоко, чтобы затем быть увлечённым в глубину. Повышение давления газа также способствует увеличению его растворимости (точнее, диффузии в жидкость) — по мере сближения частиц газа и вызванного этим роста взаимного отталкивания разность между силой отталкивания молекул газа с молекулами жидкости и между собой уменьшается, и вдруг может оказаться более выгодным вообще погрузиться в жидкость, нежели оставаться в газообразном виде. Примером тому является самый обычный углекислый газ — если при комнатных условиях его растворимость в воде весьма мала, то при относительно небольшом повышении давления она возрастает во много раз — именно поэтому в шампанском и газировке, полученной в сифоне с помощью баллончика с углекислым газом, образуется столько пузырьков, а то, что находится в сифоне, является уже не водой, а раствором угольной кислоты с ощутимо кислым вкусом!
Когда смачиваемое не смачивается?
Наверняка многие замечали, что мелкие капли воды и других жидкостей, попавшие на явно гидрофильные поверхности — почву, ткань, древесину, бумагу обычную и даже промокательную — отнюдь не всегда тут же впитываются, а иногда весьма продолжительное время пребывают там в виде шариков, как если бы поверхность была гидрофобной (водоотталкивающей). Чем меньше капли воды, тем больше вероятность такого развития событий, правда, при одном условии — гидрофильная поверхность должна быть сухой, и чем выше её сухость, тем лучше! Если же гидрофильная поверхность уже влажная, то попавшие на неё капли обычно моментально «расплываются» и впитываются. В чём же тут дело?
Всё дело как раз в сухости поверхности и в малости размера капель, а значит и их массы, не обеспечивающей должной силы удары, чтобы сразу пробить потенциальный барьер между молекулами поверхности и частицами жидкости. Именно этот потенциальный барьер увеличенной силы отталкивания разделяет поверхность и жидкость. Локальные концентрации механических напряжений, обусловленные выступами на неровной поверхности, способствуют «протыканию» барьера в этих местах. Недаром промокательную бумагу, салфетки и хозяйственные тряпки делают ворсистыми — такая структура не только удерживает больше влаги по сравнению с гладкими поверхностями, но и обеспечивает гораздо лучшую смачиваемость, а значит, более быстрое поглощение жидкости.
Впрочем, с течением времени, как правило, поверхность всё же смачивается, и капли впитываются в материал. Обусловлено это как поступлением влаги в материал в выступающих точках, где вес капли способствует «прокалыванию» потенциального барьера, так и увлажнению материала под каплей за счёт испарения жидкости. Как только такие каналы образуются и влага в материале сомкнётся с влагой в капле — происходит «пробой», канал стремительно разрастается, и капля быстро впитывается в материал.
Более того, возможно, Вы наблюдали даже такое явление, когда капельки воды, упавшие на поверхность такой же воды (например, брызги после падения в озеро крупной дождевой капли) не сразу «растворялись» в ней, а в течении секунды-другой существовали на её поверхности в виде самостоятельных шариков. Причины этого явления те же самые, да ещё свою лепту в обеспечение круглой формы капелек и минимизацию их контакта с поверхностью воды вносит поверхностное натяжение.
Поверхностное натяжение
В свете вышесказанного легко объясняется и поверхностное натяжение жидкостей. По сути, там нет никакой особой плёнки или каких-то других структурных образований, а есть лишь своеобразный потенциальный барьер, обусловленной разностью сил взаимного отталкивания молекул в жидкости и в газе. Своеобразие этого барьера заключается в том, что при расстояниях, промежуточных между имеющимися межмолекулярными расстояниями в жидкости и в газе, сила взаимного отталкивания молекул возрастает. Это обуславливает разделение жидкой и газообразной фаз, это же создаёт эффект некоей «плёнки» на поверхности жидкости.
Поэтому, по большому счёту, правы те, кто поддерживает распространённое мнение об электрической природе эффекта поверхностного натяжения. Однако дело заключается не в накоплении какого-либо потенциала на границе раздела сред. Наоборот, и разделение сред, и возможное появление такого потенциала обусловлены электромагнитным характером взаимодействия частиц как жидкости, так и газа.
В чём же состоит суть эффекта поверхностного натяжения? Изначально свободная поверхность жидкости является эквипотенциальной (в стационарных земных условиях — горизонтальной, в невесомости — сферической). При попытке несмачиваемого объекта проникнуть внутрь жидкости он деформирует эту поверхность. Однако несмачиваемость означает то, что сила отталкивания между молекулами поверхности объекта и частицами жидкости больше, чем отталкивание частиц жидкости между собой. В результате жидкость вынуждена не «прилипать» к объекту, а расступаться, оказывая противодействие его внедрению. Сила противодействия определяется силой, возникающей при подобной деформации. В некоторых ситуациях её увеличивают дополнительные факторы, например, в земных условиях добавляется сила Архимеда, вызванная прогибанием поверхности жидкости в месте воздействия. Но максимальная сила нагрузки, ещё не вызывающая погружения тела внутрь жидкости, определяется не этой силой противодействия, а разностью текущей силы отталкивания между молекулами жидкости и их максимальной силой отталкивания при удалении друг от друга, умноженной на периметр линии погружения объекта в жидкость, а точнее, периметр наименьшего контура прогибания поверхности жидкости под влиянием внешнего воздействия, который обычно находится в самой глубокой части прогиба, так как именно там будет наибольшая концентрация напряжений и именно там в первую очередь будет «взят» потенциальный барьер. Эта сила весьма невелика, и чтобы получить её численные значения, надо умножить длину периметра контакта объекта с жидкостью на коэффициент поверхностного натяжения, измеряемый, соответственно, в Н/м.
Теперь мы знаем, почему жук-водомерка не проваливается в воду, а скользит по её поверхности. Во-первых, контактирующая с жидкостью поверхность лапки должна быть несмачиваемой. Во-вторых, периметр контакта должен быть как можно больше (поэтому лапка водомерки имеет множество волосков, суммарный периметр которых намного превышает внешний периметр самой лапки). В-третьих, давление на воду должно быть достаточно слабым. По той же причине кусочек тонкой фольги может плавать на поверхности неограниченно долго (если только жидкость не обволокёт его в результате смачивания), а более толстый кусок того же металла сразу погружается в жидкость и идёт ко дну — разность сил молекулярного отталкивания уже не может компенсировать его вес.
Отсюда же ясно, что силы поверхностного натяжения играют заметную роль лишь при относительно небольших размерах объекта, когда отношение периметра к объёму достаточно велико. С ростом линейных размеров периметр растёт по линейному закону, площадь поверхности — по квадратичному, а объём и вместе с ним масса и вес — по кубическому. В результате вес растёт намного быстрее сил поверхностного натяжения, его влияние становится определяющим, и тело «проваливается» в жидкость. При уменьшении размеров, наоборот, роль объёмных сил, в частности веса, снижается, а роль поверхностных сил возрастает.
В соответствии с вышесказанным неудивительно, что по мере роста температуры поверхностное натяжение жидкости будет убывать, стремясь к нулю при достижении критической точки системы жидкость-пар. Более того, величина поверхностного натяжения непосредственно связана с теплотой парообразования, ибо и то, и другое определяется высотой потенциального барьера на границе сред, и потому при достижении температуры критической точки теплота парообразования также равна нулю. Но о теплоте парообразования более подробно поговорим в следующем разделе.
Испарение и конденсация
Массовое испарение жидкости происходит тогда, когда внешнее давление, вызванное взаимным отталкиванием молекул жидкости и частиц атмосферы, становится меньше внутреннего отталкивания между молекулами жидкости. Причиной этого может быть как повышение температуры и связанное с этим тепловое расширение жидкости, так и падение внешнего давления.
Суть процессов испарения и конденсации
Суть процесса испарения заключается в преодолении потенциального барьера на границе сред, обусловленного наличием максимума отталкивания при их взаимном удалении.
Однако ранее мы не рассматривали одну очень важную особенность этого потенциального барьера, определяющую тот факт, что испарение происходит практически при любой температуре, при которой принципиально возможно существование данного вещества в жидком виде. Дело в том, что на самом деле этого барьера нет, точнее он является виртуальным барьером. В отличии от, скажем, разницы между твёрдым состоянием вещества и текучим, заключающейся в наличии противодействия удалению (т.е. взаимного притяжения) в твёрдом состоянии, которое на некотором расстоянии сменяется способствованием удалению (т.е. взаимным отталкиванием) в жидком либо газообразном состоянии, в результате чего происходит резкое изменение свойств и поведения вещества, здесь нет такого смена знака силы — и в жидкости, и в газе частицы испытывают лишь взаимное отталкивание.
Механизмы испарения и конденсации
В силу того, что существование жидкости невозможно без обеспечения баланса вещества между жидкой и газообразной фазами, механизмы испарения и конденсации уже были подробно рассмотрены в предыдущем разделе при анализе баланса испарения и конденсации.
Физический смысл понятия критической точки системы «жидкость-пар»
Температура, при которой расстояние между молекулами жидкости (именно плотной жидкости, а не газа) соответствует максимуму отталкивания, является температурой критической точки системы «жидкость-пар». При более высоких температурах вещество не может находиться в жидкой фазе, так как молекулы не могут стабильно сблизиться на расстояния, на которых сила отталкивания при дальнейшем сближении начала бы уменьшаться. Поэтому, хотя официальная физика иногда называет закритическое состояние «отсутствием различия между жидкостью и газом», с учётом вида кривой взаимодействия можно однозначно сказать — это именно газ без всяких признаков жидкости. В технике подобное состояние водяного пара называется «сухим паром» — пока температура не упадёт ниже критической, он не может сконденсироваться ни при каких технически достижимых давлениях (теоретически можно допустить сверхвысокое давление, всё же сжавшее молекулы плотно, однако при таком чудовищном воздействии существенно изменятся свойства самих молекул, и они уже будут чем-то совсем другим, кардинально отличающимся от того, что существует в земных условиях; подобные давления современная наука приписывает лишь весьма экзотическим объектам типа «нейтронных звёзд»).
Энергия испарения и конденсации
Всем, кто хоть чуть-чуть интересовался физикой в школе, хорошо известно, что процесс испарения требует очень больших затрат энергии, а процесс конденсации, наоборот, сопровождается выделением такого же большого количества тепла. Чуть менее известно то, что теплота этих процессов зависит от температуры, при которой они происходят. Температура кипения и конденсации, в свою очередь, определяется внешним давлением, причём с ростом давления по мере приближения температуры кипения к температуре критической точки эта теплота уменьшается и в самой критической точке обнуляется.
Впрочем, если говорить более строго, то на самом деле теплота кипения зависит не от температуры кипения, а от давления, определяющего и эту температуру, и эту теплоту.
Причины появления теплоты испарения-конденсации
Итак, каков механизм теплоты испарения? Он прост. Для того, чтобы преодолеть потенциальный барьер на границе сред, частица жидкости тем или иным образом должна получить относительно большую энергию, например, оказавшись в пучности волны теплового возмущения.
Пройдя дистанцию наибольшего отталкивания, частица становится «испарившейся», но продолжает ускоряться, поскольку отталкивание от жидкости всё ещё превышает отталкивание со стороны довольно далёких и относительно немногочисленных частиц газа. В результате она приобретает дополнительное ускорение и энергию. За счёт чего? За счёт энергии жидкости — ведь частица не вернула обратно всю энергию, которая досталась ей, когда она попала в пучность тепловой волны! В результате часть энергии жидкости она унесла с собой в газовую фазу, а энергия эта в конечном счёте перешла в потенциальную форму, выразившись в некотором повышении среднего давления газовой фазы в замкнутом объёме, либо так и осталась в виде кинетической энергии покинувшей жидкость частицы, если она вылетела в неограниченный объём вакуума. И то, и другое не повысит температуру газа, но понизит температуру жидкости — так возникает теплота испарения.
А если частица жидкости испарилась из-за локального падения давления в результате его тепловой нано-флуктуации? А всё будет точно также — поскольку размер этой флуктуации достаточно велик, то на неё приходится как минимум несколько молекул, и очевидно, что наибольшие шансы покинуть жидкость имеет та из них, которая в этот миг в своём «тепловом дрожании» как раз стремилась наружу! Всё то же самое, только энергии для покидания жидкости ей потребовалось меньше.
Не менее очевидны и причины теплоты конденсации. Когда частица преодолевает потенциальный барьер и устремляется к жидкости, она испытывает большее отталкивание от оставшихся позади молекул газа, нежели от молекул жидкости. Такой дисбаланс отталкиваний порождает её дополнительное ускорение в сторону жидкости, в результате она подходит к поверхности жидкости с приличной скоростью и передаёт ей свою кинетическую энергию, порождая в жидкости ударную волну, которая становится одной из множества тепловых волн. В результате температура жидкости возрастает, а поскольку число частиц в газовой фазе уменьшилось, потенциальная энергия (суть давление) газовой фазы, находящейся в замкнутом объёме, уменьшается. В бесконечном вакууме у частиц нет причин поворачивать обратно к жидкости, с которой они испытывают только отталкивание, поэтому там конденсация невозможна. Однако если в вакууме мы с помощью какого-то источника создадим струю газа, направив её в жидкость, то частицы из этой струи вполне могут конденсироваться в этой жидкости, повышая её температуру за счёт своей кинетической энергии. Но надо помнить, что эту энергию они получили, в свою очередь, за счёт источника струи, так что закон сохранения энергии и в этом случае выполняется.
Поскольку и в том, и в другом случае энергию определяет высота потенциального барьера над «нормальным» уровнем для той или иной температуры, неудивительно, что при любой конкретной температуре теплота плавления равна теплоте конденсации.
Оценка теплоты испарения-конденсации
По аналогии с плавлением-кристаллизацией, проведём анализ теплоты испарения, приходящейся на одну молекулу.
Из данных таблицы, составленной почти для 40 разных веществ, следует, что соотношение энергии квантов при температуре плавления к теплоте плавления, приведённой к одной молекуле, не зависит ни от типа химических связей, ни от веса молекул, ни от температуры кипения и при собственных температурах кипения в нормальных условиях составляет от 1.8 до 3.4 кванта (в среднем 2.21). Несколько особняком стоят гелий, водород и неон, кипящие при сверхнизких температурах — менее 30 К, — у них зависимость энергии от температуры явно выражена и составляет от 0.47 у гелия до 1.6 у неона.
Главный вывод, следующий из таблицы, заключается в том, что процессы испарения и конденсации, также как и плавления и кристаллизации, не носят квантового характера. Другой вывод менее банален и несколько необычен — у всех рассмотренных веществ температура кипения при атмосферном давлении «выбрана» природой таким образом, чтобы на один атом приходилось два-три кванта теплового излучения, соответствующего данной температуре. Случайно ли это или здесь кроются более глубокие причины?
Газообразное состояние вещества
С физической точки зрения газообразное состояние вещества является наиболее простым и понятным. Здесь нет фазовых переходов, а взаимозависимости термодинамических параметров практически всегда монотонны и вполне успешно описываются простыми математическими формулами. Все резкие изменения физических свойств газа обычно связаны лишь с протеканием химических реакций между его компонентами в случае, когда создаются подходящие для этих реакций условия, и с ионизацией молекул газа и переходом его в плазму по мере роста температуры. Не случайно преподаваемая как в школах, так и в ВУЗах термодинамика почти полностью посвящена именно термодинамическим процессам в газах, а описанию всех остальных состояний вещества обычно посвящается лишь несколько туманных слов.
Газообразное состояния вещества на кривой взаимодействия
На кривой взаимодействия газообразному состоянию вещества соответствует область от точки максимума силы отталкивания и до бесконечности.
 Область газообразного состояния вещества на кривой взаимодействия выделена жёлтым цветом.
В газообразном состоянии всё действительно вполне прозрачно — чем дальше частицы газа находятся друг от друга, тем меньше их взаимное отталкивание и тем меньше общая потенциальная энергия газа. Поэтому газу энергетически выгодно равномерно заполнить весь выделенный ему объём. Этим же объясняется и низкое давление на стенки разреженных газов — ведь межмолекулярные расстояния там велики, и сила отталкивания, передающаяся на стенки в виде давления газа, мала. По сути, там действует лишь кинетическая компонента давления.
Особенности газообразного состояния вещества
Особенности разреженных газов
В разреженных газах расстояния между частицами весьма велики и превышают их размеры в сотни, тысячи, а то и миллионы раз. В результате силы отталкивания малы или крайне малы, поэтому давление таких газов на стенки погружённых в них объектов также мало, а взаимное влияние частиц становится ощутимым лишь тогда, когда они сближаются достаточно близко — такое происходит нечасто. Остальное время в своём хаотическом тепловом движении частицы газа путешествуют без серьёзного воздействия соседей и могут не испытывать существенных изменений траекторий, проходя путь в десятки и сотни средних межмолекулярных расстояний. Однако даже в этом случае траектория их не прямолинейна: в силу дистанционного электромагнитного воздействия соседних частиц она плавно искривляется в ту или иную сторону, тем более что большие межмолекулярные расстояния обеспечивают хотя и слабое, но относительно длительное влияние соседних частиц.
В результате движение частиц не похоже на «метание в клетке-глобуле», но оно не похоже и на идеально прямолинейные траектории бильярдных шаров, как об этом говорит МКТ — ведь наши «бильярдные шары» испытывают слабое (иногда очень слабое, но всегда теоретически ненулевое!) взаимное отталкивание даже на самом большом расстоянии.
Следует отметить, что электромагнитное взаимодействие при росте расстояния между частицами уменьшается слишком быстро — обратно пропорционально 6-й степени, — и уже на расстоянии в несколько десятков радиусов частиц становится исчезающе малым. Поэтому львиную часть давления разреженных газов составляет кинетическая компонента, обусловленная их ударным воздействием друг на друга и на стенки сосудов. Электромагнитное же взаимодействие в этом случае отвечает главным образом лишь за «идеальность» безконтактных «столкновений» частиц газа между собой в те редкие моменты, когда они сближаются почти вплотную друг с другом. В результате сила воздействия на стенки в полном соответствии с МКТ становится практически пропорциональна частоте и силе ударов — то есть давление пропорционально температуре и обратно пропорционально объёму.
Таким образом, в качестве критерия «разреженности» газа можно предложить преобладание кинетической «ударной» компоненты давления над потенциальной «силовой». Для разреженных газов характерен слабоглобулярный характер движения частиц, весьма близкий к абсолютно хаотическому движению по МКТ.
Особенности газов под высоким давлением
Высокое давление газа означает большую силу взаимного отталкивания частиц газа, а следовательно, весьма высокую концентрацию его частиц. Поскольку сила отталкивания при этом велика, велико и давление на стенки сосуда, в котором находится газ, велика и потенциальная энергия этого газа, которая сразу проявится в виде его взрывного расширения, лишь стоит ограничивающим стенкам утратить необходимую прочность.
Так как расстояния между частицами газа при высоком давлении относительно невелики, то силы отталкивания существенны в любом месте пространства между ними. Поэтому при не слишком больших скоростях и, соответственно, кинетической энергии частиц газа (определяемой текущей температурой), потенциальные барьеры вблизи частиц могут быть достаточно велики, чтобы эффективно ограничивать область движения каждой частицы небольшим пространством в середине между её соседями. В результате практически всё движение такой частицы происходит в небольшой области пространства — глобуле — и лишь изредка частице удаётся перескочить в другое место, когда её соседи в результате теплового движения одновременно разойдутся в разные стороны, образовав «щель» с пониженным потенциалом, куда сможет «пролезть» наша частица. Таким образом, в газах под высоким давлением при низкой температуре частицы не движутся хаотически по всему объёму, а подавляющую часть времени проводят в весьма ограниченных областях пространства — глобулах.
Ещё одна особенность заключается в том, что при приближении частиц газа друг к другу сила отталкивания уже не обратно пропорциональна 6-й степени этого расстояния, как это происходит на дальних дистанциях, — эта зависимость приближается к обратно-квадратичной. К тому же величина кинетической (ударной) компоненты давления становится сравнимой и даже малой по сравнению с потенциальной (силовой). В результате изменяется характер зависимости давления от объёма, который вынуждает использовать поправки Ван-дер-Ваальса.
Резюмируя вышесказанное, в качестве критерия «высокого давления» газа можно предложить преобладание потенциальной «силовой» компоненты давления над «ударной» кинетической. Для газов под высоким давлением характерно преобладание движения частиц внутри своих глобул, а не по всему объёму, заполненному данным газом.
Особенности газов при нагревании
При нагревании газа увеличивается скорость теплового движения его частиц, а значит и кинетическая составляющая его давления. Поэтому при росте температуры поведение любого газа начинает всё более походить на поведение разреженных газов, хотя абсолютное давление при этом растёт за счёт возрастания кинетической составляющей.
Когда температура становится достаточно высокой, происходит тепловая ионизация частиц газа, они превращаются в ионы, а газ переходит в фазу плазмы. В связи с появлением у частиц плазмы явно выраженных зарядов, электромагнитное взаимодействие на дальних расстояниях становится обратно пропорционально уже не 6-й, а 2-й степени этого расстояния, то есть вызванное расстоянием затухание дистанционного взаимодействия уменьшается, а его эффективная дальность возрастает. Но самое главное, частицы плазмы начинают испытывать притяжение к одним частицам (чего не наблюдалось в неионизованном состоянии) и продолжают испытывать отталкивание с другими, причём из-за появления явного дисбаланса зарядов эти силы заметно возрастают. При наличии внешних электромагнитных полей поведение плазмы начинает существенно отличаться от поведения неионизованного газа. Однако в отсутствии таких внешних полей, при наличии лишь механических и тепловых воздействий, общие принципы поведения плазмы такие же, как у неионизованного газа. Поэтому с термодинамической точки зрения я склонен рассматривать плазму как фазовую разновидность газообразного состояния, а не как самостоятельное агрегатное состояние вещества.
Агрегатные состояния вещества на кривой взаимодействия
И в заключение сведём воедино показанные по отдельности выше фрагменты кривой взаимодействия во взаимосвязи с различными агрегатными состояниями вещества. Напомню, что горизонтальная ось соответствует минимально возможному расстоянию между атомами (молекулами) вещества, возрастающему с повышением температуры. Вертикальная ось соответствует силе их взаимодействия, определяемой этим расстоянием.
 Агрегатные состояния вещества на кривой взаимодействия. Красные участки графика соответствуют взаимному притяжению молекул, синие — отталкиванию.
Подробное рассмотрение особенностей твёрдого, жидкого и газообразного состояний, а также переходов между ними — плавления-кристаллизации и испарения-конденсации изложено выше. Здесь я лишь отмечу, что области твёрдого и газообразного состояний являются «безусловными», а вот будет ли существовать вещество в виде жидкости или пара — зависит от сочетания давления и температуры (точнее, определяемого температурой минимально возможного расстояния между молекулами вещества).
В области сверxвысоких давлений, обозначенной справа, атомы испытывают взаимное отталкивание, поскольку давление сближает их на расстояние, на котором определяющее влияние начинает оказывать нейтронный барьер. Достичь этой области, особенно при температурах, существенно превышающих абсолютный нуль, крайне сложно. Условия при этом должны приближаться к тем, что приписываются недрам так называемых «нейтронных звёзд».
♦
|